瀏覽人次:【9100】
隨著高齡化社會的來臨,「醫療保健」已經成為大家十分重視的議題。幸運的是,隨著微奈米技術日漸純熟,加上半導體電子產業的蓬勃發展,使得生醫產品能夠做到微小化以及個人化,帶給生物醫療領域無窮的開發潛力。而近年來,應用在活體內的生理訊號感測和藥物治療漸漸受到強烈地注目,科學家們也開始紛紛投入相關的科學研究。
而即使我們已經有能力隨時感測生理資訊並檢測出疾病,但面臨一些像是心臟病等突發性心血管疾病,若無法給予第一時間的及時治療,很可能造成無可彌補的遺憾。傳統吃藥或是打針的方式,一來需要經過身體的循環系統才能到達患部;二來可能需要專業的醫療人員到場,容易因此喪失了治療的黃金時間。
此外,癌症是目前人類主要死亡原因之一。針對癌症的醫療除了電療、化療及手術之外,還需要定時給予癌症藥物及止痛劑。藥物經消化系統供人體吸收或經靜脈注射隨血液循環到達患部,其濃度將會被稀釋。為了要達到治療劑量,病人就得承受強烈副作用,癌症患者在忍受多種醫療行為已身心俱疲之下,服用多種藥物對癌症患者而言更是另一種痛楚。
有鑑於此,新型的植入式釋藥元件於是被提出[1],可藉由精準控制藥量或時間等藥物釋放參數,提供更即時、更有效率的藥物治療。但美中不足的是,以往植入式的釋藥元件,必須和所需要的無線控制電路晶片在PCB電路板上做結合,成本較高且體積較大,容易造成植入者的不安和恐懼感。因此,在本篇文章中,我們提出了第一個醫療用可植入式CMOS釋藥系統單晶片,整合無線控制/驅動電路以及一個藥物傳遞陣列(drug delivery array)於同一個CMOS矽晶片中[2]。此晶片相較於現有技術,具有成本較低、體積較小以及低功率消耗等優點,並可透過微創手術植入人體,所具備的無線功能也可讓醫療人員對病患進行非侵入性的即時治療。SoC可釋放如nonapeptide leuprolide acetate、硝化甘油(nitroglycerin)等藥物,適合應用於局部診斷或是癌症的治療,也可為心臟病患者提供即時處置[3]。
植入式釋放藥物元件
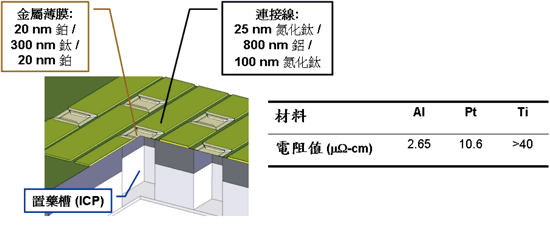
圖一為釋藥元件結構圖。藥物陣列中的每個單元包含一藥物儲存槽(reservoir)以及覆蓋在儲存槽上方的金屬薄膜(membrane)。晶片上的金屬線(trace)與薄膜相連用以流通電流。金屬薄膜由多層次的鈦(Ti)與白金(Pt)組成,透過IC後製程微影技術(post-IC photolithography)及剝離製程(lift-off process)將之實現;而藥物儲存槽則是利用與CMOS製程相容的深層乾式蝕刻(deep dry etching)技術,從晶片背面挖洞而成[4]。之所以會選擇鈦和白金作為薄膜材料,除了其本身材料特性適合此實驗外,更重要的是它們皆已被應用於標準CMOS製程[5]且具有良好之生物相容性[6]。
《圖一 釋藥元件結構圖》
 |
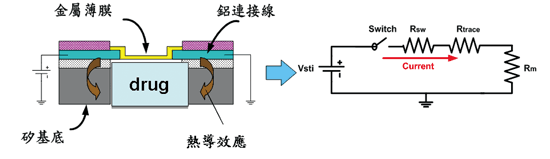
為了能滿足最後與電路整合的目標,藥物的釋放必須能由電訊號所驅動,故在驅動方式的選擇上,我們採用單純的電熱(Electrothermal)燃燒的方式。釋放藥物的驅動過程其實和保險絲的原理類似,其模型如圖二所示,由於金屬(Ti/Pt)薄膜和鋁導線之間的厚度及電阻係數的差異,當通過一大電流時,所產生的焦耳熱會聚集在金屬薄膜中央。且因為薄膜為懸浮結構,產生的熱不易散去,於是溫度快速增加而最終導致薄膜破裂,藥物即可釋放出來;其具備了體積小、主動釋放以及固體和液體藥物都可裝填等優點。
《圖二 植入式釋藥元件模型》
 |
CMOS無線釋藥系統單晶片(SoC)
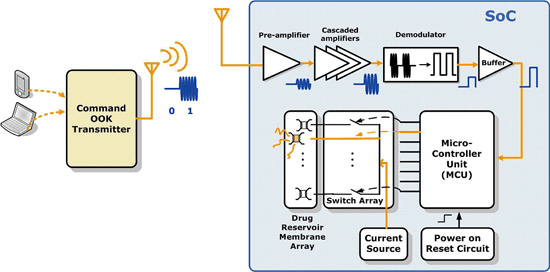
圖三描述此無線釋藥系統的架構。無線接收機(receiver)採用OOK解調機制,由於不需要混波器及壓控震盪器等元件,具有很小的面積,其包含共源極前置放大器、串聯放大級、解調用封包檢測電路、數位化比較器以及輸出緩衝器。微處理器(micro-controller unit;MCU)內含時脈除法器、解碼器和UART單元。為確保微處理器內的暫存器皆有給定的初始值,以避免錯誤放藥的情形,開機重置電路(power-on-reset circuit)也被整合進來,其SoC整體系統電路如圖四所示。
為了通過大電流於金屬薄膜,開關陣列的尺寸設計相對較大。在運作時,一個RS232規格的外部指令訊號會無線傳送到SoC,並由OOK接收器接收解調;然後晶片上微控制器會根據解調後的指令,透過開關把電流傳送到所選擇之藥物儲存槽外部薄膜,使其活化破裂並釋出藥物。
《圖三 無線釋藥系統架構圖》
 |
《圖四 SoC整體系統電路圖》 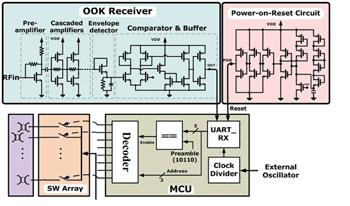 |
此晶片含有八個可尋址的藥物釋放單元及其相關電路,以標準0.35微米CMOS製程技術生產,晶片面積為1.77mm×1.4mm。圖五為做完後製程後,其正面與背面的晶片照,可以清楚看到藥物儲存槽和表面金屬薄膜。受限於晶片本身的面積和厚度,可儲存的藥物容積有限。為了達到實用的目的,可將儲藥槽的容積增加,在此利用軟微影技術(soft lithography technology),以翻模的方式來製作高分子材料聚二甲基矽氧烷(Polydimethylsiloxane;PDMS)的擴充儲藥槽,如圖六所示,其中PDMS亦為生物相容性材料。當黏接完PDMS擴充儲藥槽後,其每個藥物儲存容積約為100nL。
《圖五 晶片正面及背面照》 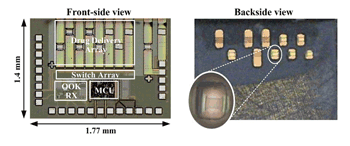 |
《圖六 SoC晶片添加擴充儲藥槽》  |
《》
 |
圖七為晶片和其系統封裝示意圖。藥物傳遞裝置的電源可以為一種可充電的鋰離子奈米線電池(lithium-ion nanowire battery)[7],擁有很高的能量密度;此外還有一個微型(約3mm × 3mm)螺旋電感,可以用來作為電感從外部裝置擷取能量也可當成接收無線指令訊號的環形天線[8]。整個藥物傳遞裝置能放進一個生物相容的PDMS封裝中[6],避免人體對其產生排斥作用。
《圖七 晶片和其系統封裝示意圖》
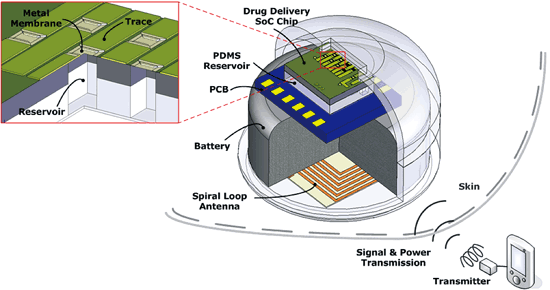 |
藥物釋放量測結果
圖八為金屬薄膜加熱前後的照片;明顯可看出經MCU指定的金屬薄膜在通過電流加熱後,產生結構上的破裂。這也間接表示,晶片上的CMOS電路在經過必要的後製程步驟後依然可以成功地運作,其整體電路量測結果列於表一。量測薄膜上動態驅動電流對時間的暫態曲線如圖九所示,從進行活化的電流傳出到薄膜破裂後釋出藥物所需的時間約為50毫秒(milliseconds)。由於薄膜面積很小且加熱時間很短,所產生的總熱量不高,不會產生破壞人體組織或藥物變質等不良影響。文獻中也有類似的研究指出,當藥物容積為120nL時,上升溫度不會超過10℃[9]。
《圖八 金屬薄膜通過電流前後的照片》  |
(表一) 整體電路量測規格表
Technology |
TSMC 0.35μm CMOS |
Supply Voltage |
1.8V |
Chip Size |
2.48mm2 |
Power Consumption |
7.2mW |
Operation Frequency |
402~405MHz(MICS band) |
MCU Operation Clock |
4MHz |
Receiver Sensitivity
(at data rate : 5kbps) |
-61dBm at 403MHz |
Data Rate |
< 6Mbps |
Nominal Activation Current |
45mA |
《圖九 金屬薄膜驅動電流的暫態反應》 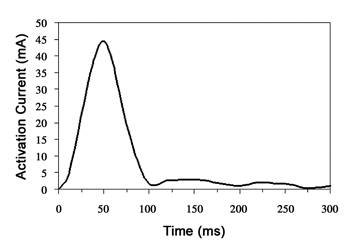 |
此裝置目前仍在實驗室研究階段,尚未在活體內進行實驗。實驗步驟如下:我們將釋藥裝置浸泡於去離子水(DI water)中,並選擇藍色的染劑當作藥物存於儲藥槽內;接著,依序將電流灌到指定的金屬薄膜。當指定的薄膜破裂後,染劑會釋放出來,即可使用顯微鏡搭配CCD攝影機觀察與紀錄水中染劑濃度的分布。若水中染劑的濃度可以被控制,即推論可以操控藥物的釋放。染劑的濃度可藉由分析RGB影像中藍色的比例得到。圖十為觀測兩不同時間燒破之開口間某一點的濃度對時間分布圖。可看到在兩次釋放藥物的同時,濃度會有明顯的增加而出現峰值,但是接著藥物濃度會因擴散作用而慢慢減少,到達一穩定值。
《圖十 量測不同時間釋放之兩開口(A,B)間某一點(M)的藥物濃度對時間關係圖》  |
結論
為有效達到第一時間的即時治療,我們提出了第一個可無線命令之釋藥系統單晶片,整合釋藥元件與電路,體積及成本可大大減小。該晶片具有生物相容性及無線傳輸能力,可透過微創手術植入人體,並藉由PDA等無線裝置精密控制藥物釋放以達到非侵入式的即時治療效果。遠處的醫療人員更可透過無線功能,直接對病患進行即時醫治,達到「遠距醫療」的目的。此外,這項研究成果已在2009年國際固態電路會議發表[2],並在媒體以標題「Implantable drug-delivery SoC shows promise的文章報導[10]。
--本文作者黃毓傑為台灣大學電子工程研究所博士班學生;廖信宏為台灣大學機械工程研究所博士班學生;黃本立為台灣大學電子工程研究所博士班學生;楊燿州為美國麻省理工學院博士,現任國立台灣大學機械工程學系教授;林啟萬為美國凱斯西儲大學醫學工程博士,現任國立台灣大學電機工程學系教授;呂學士為美國明尼蘇達大學電機工程博士,現任國立台灣大學電機工程學系教授兼電子工程研究所所長。
參考資料
[1] S. Smith, T. B. Tang, J.G. Terry, J. T. M. Stevenson, B. W. Flynn, H. M. Reekie, A. F.Murray, A. M. Gundlach, D. Renshaw, B. Dhillon, A. Ohtori, Y. Inoue and A. J. Walton,“Development of a miniaturized drug delivery system with wireless power transfer and communication”, IET Nanobiotechnology, 1 (5), pp. 80-86, 2007.
[2] Yao-Joe Yang, Yu-Jie Huang, Hsin-Hung Liao, Tao Wang, Pen-Li Huang, Chii-Wan Lin, Yao-Hong Wang, Shey-shi Lu, “A Release-on-Demand Wireless CMOS Drug Delivery SoC Based on Electrothermal Activation Technique,” IEEE, ISSCC, San Francisco, Feb. 2009
[3]. C. L. Randall, T. G. Leong, N. Bassik, and D. H. Gracias, “3D lithographyically
fabricated nanoliter containers for drug delivery,” Advanced Drug Delivery Reviews, vol.59, pp. 1547-1561, 2007.
[4] Tao Wang, Hsiao-Chin Chen, Hung-Wei Chiu, Yo-Sheng Lin, Guo Wei Huang,
Shey-Shi Lu "Micromachined CMOS LNA and VCO by CMOS Compatible ICP Deep Trench Technology," IEEE Tran. on Microwave Theory and Technique, vol. 54, no. 2,pp.580-588, Feb. 2006.
[5] M. S. Smith, Application-Specific Integrated Circuits, Addison-Wesley, 1997, pp.56-57.
[6] M. C. Bélanger, and Y. Marois, “Hemocompatibility, biocompatibility, inflammatory and in vivo studies of primary reference materials low-density polyethylene and polydimethylsiloxane: A review,” Journal of Biomedical Materials Research Part B:Applied Biomaterials, Vol. 58, pp. 467-477, July 2001.
[7] C. K. Chan, H. Peng, G. Liu, K. McIlwrath, X. F. Zhang, R. Huggins and Y. Cui,
“High-performance lithium battery anodes using silicon nanowires”, Nature Nanotechnology, vol.3 (1), pp. 31-35, Jan.2008.
[8] R. N. Simons, F. A. Miranda, J. D. Wilson, and R. E. Simons, “Wearable Wireless Telemetry System for Implantable Bio-MEMS Sensors”, Proceedings of the 28th IEEE EMBS Annual International Conference, New York City, USA, Aug 30-Sept 3, 2006.
[9] J. M. Maloney, S. A. Uhland, B. F. Polito, N. F. Sheppard Jr., C. M. Pelta, and J. T.Santini Jr., “Electrothermally activated microchips for implantable drug delivery and biosensing”, Journal of Controlled Release, Vol. 109, pp. 244-255, 2005.
[10] Dylan McGrath, “Implantable drug-delivery SoC shows promise”, retrieved
February 11, 2009, from
http://www.eetimes.com/showArticle.jhtml?articleID=213403298
|